来源:奇点网
 图片来源:pixabay
图片来源:pixabay
我们对抑癌基因P53和癌症之间关系的认知,又得升级了。
今天,以色列希伯来大学医学院Yinon Ben-Neriah领衔的研究团队,在《自然》杂志上发表了一项突破性研究成果。
他们发现两种常见的功能获得性促癌p53突变,实际上有很强的抑癌能力,甚至比正常p53更强,只不过在肠道微生物代谢产物没食子酸等的影响下,这两种突变型p53超强的抑癌能力被完全消除,最终导致肿瘤进展不受控制。
Ben-Neriah团队的这个发现不仅解释了为什么小肠癌很罕见,但结直肠癌却是人类因癌症死亡的主要原因;还证实了促癌基因突变其实有很强的可塑性,以及携带这些突变的细胞所处的微环境,决定了突变的真正功能。
 论文截图
论文截图
在医学界,有个问题一直困扰着医生们,那就是肠癌为什么好发于结直肠(占98%),而小肠癌却非常罕见(2%)。
Ben-Neriah团队也一直在思考这个问题,他们觉得可能是肠道微生物在背后捣鬼,因为相较而言,小肠肠道微生物少,而结直肠微生物非常丰富。
为了检验上述猜测,Ben-Neriah和他的同事将两个人类中最常见的p53突变(R175H和R273H,对应小鼠p53的R172H和R270H)引入小鼠肠道。我们都知道p53是重要的抑癌蛋白,由TP53基因编码,而p53的功能缺失突变以及功能获得突变,是癌症发生和进展的重要原因。
为了严谨起见,研究人员将p53突变引入到两种WNT驱动的肠癌小鼠模型中(ApcMin/+和Csnk1a1肠道诱导缺失)。结果让他们兴奋,因为非常好的再现了医生在临床上观察到的现象:p53突变的引入,在不同的肠段表现出截然相反的表型,结肠和回肠(远端肠道)上皮高度发育不良和增生,而十二指肠和空肠(近端肠道)则表现出正常的增生水平。
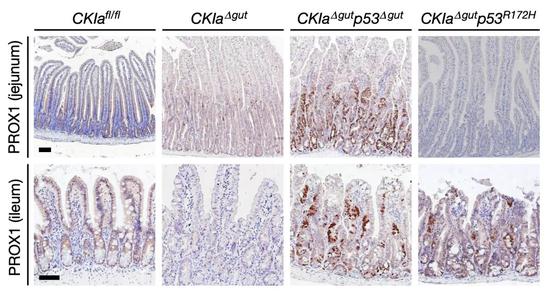 空肠(上)和回肠(下)受突变型p53的影响
空肠(上)和回肠(下)受突变型p53的影响
进一步研究小鼠肠道的肿瘤形成特点之后,研究人员认为,突变型p53的促癌作用似乎在某些条件下被反转了。
这究竟是为什么呢?
在正常情况下,没有发生突变的p53蛋白是通过转录激活抗增殖和促凋亡基因(如:p21和Bax)发挥抑癌的作用,那Ben-Neriah团队引入的突变p53可能是重新获得了转录激活作用。
不过,研究结果推翻了这一猜想。因为与没有突变的p53相比,有R172H突变的p53与染色质的相互作用几乎完全被消除,根本没办法实现转录激活。基于这个数据,研究人员认为,突变p53在空肠中的肿瘤抑制作用不是基于转录激活。
在另一种ApcMin/+小鼠模型中,研究人员发现了一样的规律:p53 R172H突变的引入,导致结肠肿瘤发生增多,但减轻了近端肠道的肿瘤负担。
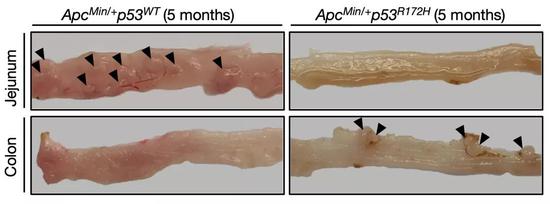 在另一个模式小鼠的空肠和结肠再现之前的研究成果
在另一个模式小鼠的空肠和结肠再现之前的研究成果
既然突变的p53抑癌作用与正常p53不一样,那么这背后的机制究竟是什么呢?
在后续的研究中,Ben-Neriah和他的同事发现,本研究引入的突变型p53能减少转录因子TCF4与染色质的结合,进而抑制WNT通路的激活,最后实现抑制肿瘤发生和生长的作用。
而且他们还通过将突变的p53转到腺瘤类器官中,研究了突变型p53的抑癌作用,结果显示突变型p53的抑癌效果远强于正常p53。
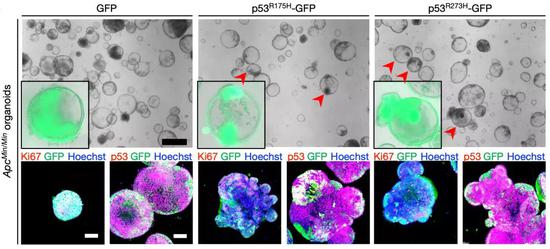 类器官研究证实了突变型p53超强的抑癌能力
类器官研究证实了突变型p53超强的抑癌能力
此外,研究人员还发现,突变型p53在回肠中似乎也能发挥抑癌作用。这表明,是时候研究肠道微生物对p53功能的影响了。
最直接的办法就是用抗生素清除肠道微生物,而且这个操作效果非常显著。
研究人员注意到,只有转入突变型p53的小鼠受抗生素的影响:用抗生素之后,结肠和回肠中观察到的发育不良消失了,而且肠道的健康状态也变得更好了。
 抗生素(ABX)对突变型p53表型的影响
抗生素(ABX)对突变型p53表型的影响
从分子和细胞水平上看的话,使用抗生素之后,携带突变型p53的肠道细胞促癌的WNT通路激活减少,回肠和结肠中的细胞增殖减少。
以上数据表明,确实是肠道微生物将突变型p53的强力抑癌作用转换成了促癌作用。
那么肠道微生物又是如何做到的呢?
按照以往的经验,问题应该出现在肠道微生物的代谢产物上。
于是Ben-Neriah和他的同事对小鼠肠道微生物代谢产物做了筛选,并分成4大类:短链脂肪酸(丁酸盐和己酸盐等)、脂质衍生物(脱氧胆酸盐等)、异硫氰酸盐(sulforaphane等)和多酚类(尿石素B,鞣花酸和没食子酸等)。
然后分别用四类代谢产物处理携带突变型p53的肿瘤类器官,观察类器官形态、增殖能力,以及WNT通路活性的变化。
结果只有多酚类代谢产物有作用。进一步深入研究之后,将目标缩小到了没食子酸。
也就是说,只有没食子酸能提高携带突变p53类器官的增殖能力,和WNT通路的活性。更重要的是,没食子酸的这种能力是特异性的。而且,除去没食子酸4天之后,携带突变型p53的肿瘤类器官,就失去了增殖能力,形态恢复正常,WNT通路的活性也下降。
这说明,没食子酸的持续存在是消除突变型p53抑癌能力所必需的。
 持续供应没食子酸(GA)和去除没食子酸对类器官形态的影响
持续供应没食子酸(GA)和去除没食子酸对类器官形态的影响
随后研究人员在体内探索了没食子酸的分布,满是细菌的回肠果然比细菌稀少的空肠浓度高,这也间接证实了之前的发现。
据了解,目前已经在人体内发现两种能产生没食子酸的细菌,它俩是植物乳杆菌和枯草芽孢杆菌[6]。这两种细菌主要利用莽草酸脱氢酶(SDH)合成没食子酸。
研究人员还分析了小鼠空肠、回肠和结肠中SDH基因的丰度,也确实是空肠少,回肠和结肠多。
当研究人员用没食子酸喂食被抗生素处理过的突变型p53小鼠之后,突变型p53的抑癌活性就完全消失了,小鼠的回肠和结肠变得过度增生,出现丰富的高等级发育不良灶,WNT通路的基因在整个回肠和结肠中被高度激活。
总的来说,这个研究表明p53突变具有很强的可塑性,而且肠道微生物在塑造p53突变功能方面有重要作用。
“从科学上讲,这是一个新领域,”Ben-Neriah说,“微生物组对癌症突变影响的程度让我们吃惊,在某些情况下,甚至是完全改变了突变的性质。”
这个研究提示,那些结直肠癌高危人群可能要关注他们肠道菌群的变化,并且在吃没食子酸含量丰富的食物时,需要三思而行。







